NOVÉ POZNATKY O STRUKTUŘE KOMPLEXU FOXO4:p53 – KLÍČOVÉHO FAKTORU V REGULACI STÁRNUTÍ BUNĚK (9.4.2022)
Transkripční faktor p53 brání tomu, aby se vlivem stresu staly z normálních buněk buňky nádorové. Za stresových podmínek p53 interaguje s dalším transkripčním faktorem FOXO4 (Forkhead box O 4) a společně pak zvyšují produkci proteinu p21, což spouští proces stárnutí buňky (senescenci). Molekulární mechanismus zvyšování transkripce p21 je však stále nejasný. V práci publikované v časopise Protein Science vědecké týmy Dr. Obšilové (FGÚ AV ČR), prof. Obšila (PřF UK a FGÚ AV ČR) a jejich kolegů z ÚOCHB AV ČR charakterizovali vzájemné interakce proteinů p53 a FOXO4 na molekulární úrovni. Nové poznatky o struktuře komplexu naleznou využití při vývoji specifických inhibitorů interakce mezi oběma proteiny, a následně pak při vývoji nových léčiv zaměřených na selektivní eliminaci senescentních buněk.
V této strukturní studii vědci provedli podrobnou charakterizaci interakcí v komplexu FOXO4:p53 pomocí integrovaného přístupu zahrnujícího analytickou ultracentrifugaci, nukleární magnetickou rezonanci a chemické zesítění spojené s hmotnostní spektrometrií. Protože FOXO4 i p53 mají více domén (viz. obr), studovali roli jednotlivých domén a neuspořádaných segmentů obou proteinů a zmapovali jejich interakční rozhraní. Zjistili, že zcela zásadní pro celkovou stabilitu komplexu p53:FOXO4 je interakce mezi transaktivační doménou TAD p53 a Forkhead doménou FOXO4. Na tvorbě komplexu se dále podílejí kontakty zahrnující N-koncový neuspořádaný segment FOXO4, C-koncovou negativní regulační doménu p53 a DNA-vazebné domény obou proteinů. Měřením vazby na DNA dále zjistili, že tvorba komplexu p53:FOXO4 blokuje vazbu p53 na DNA, aniž by však ovlivnila DNA-vazebné vlastnosti FOXO4.
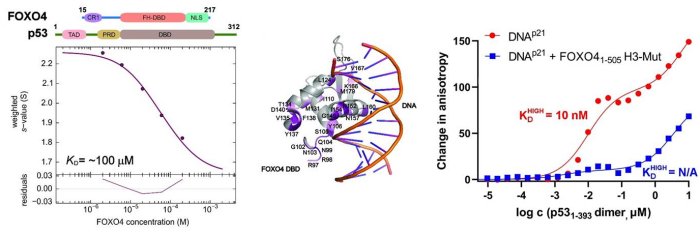
Vlevo, analýza interakce mezi FOXO4 a p53 pomocí analytické ultracentrifugace, metodou sedimentační rychlosti. Uprostřed, změny v chemických posunech 15N-značeného FOXO4 v přítomnosti p53 získané z 1H-15N HSQC spekter namapované na krystalovou strukturu komplexu FOXO4 DBD:DNA. Vpravo, měření změn anisotropie fluorescence ukazující, že tvorba komplexu inhibuje vazbu p53 na DNA.
Mandal R, Kohoutova K, Petrvalska O, Horvath M, Srb P, Veverka V, Obsilova V and Obsil T. FOXO4 interacts with p53 TAD and CRD and inhibits its binding to DNA. Protein Sci. roč. 31, č. 5 (2022), č. článku e4287. IF = 6.725. DOI: 10.1002/pro.4287.
