Mechanismus regulace proteinkinasové aktivity ASK1
Náš výzkum umožnil strukturní náhled na komplexy ASK1 kinasy s jejími dvěma přirozenými inhibitory: proteinem 14-3-3 a thioredoxinem. Naše data by mohla být důležitá k porozumění procesu inhibice ASK1 stejně tak jako úlohu proteinů 14-3-3 v regulaci ostatních enzymů.
ASK1 kinasa je důležitým členem MAP3K proteinkinasové rodiny. Pod vlivem různých stresových podnětů jako je buněčný stres či expozice ultrafialovému záření se ASK1 spolupodílí na iniciaci signální kaskády, která vede k aktivaci MAPkinas JNK a p38. Aktivace JNK a p38 signálních kaskád indukuje pak následné stresové odpovědi jako buněčná smrt přes kaspasu 3 a 9. Funkce ASK1 kinasy je tedy spojována s aktivací apoptózy v různých tkáních a hraje klíčovou úlohu v patogenezi řady chorob včetně rakoviny, neurodegenerace a kardiovaskulárních chorob. Kinasová aktivita ASK1 je regulována mnoha faktory včetně vazby thioredoxinu (Trx) a proteinu 14-3-3, které oba fungují jako přirozené inhibitory ASK1.
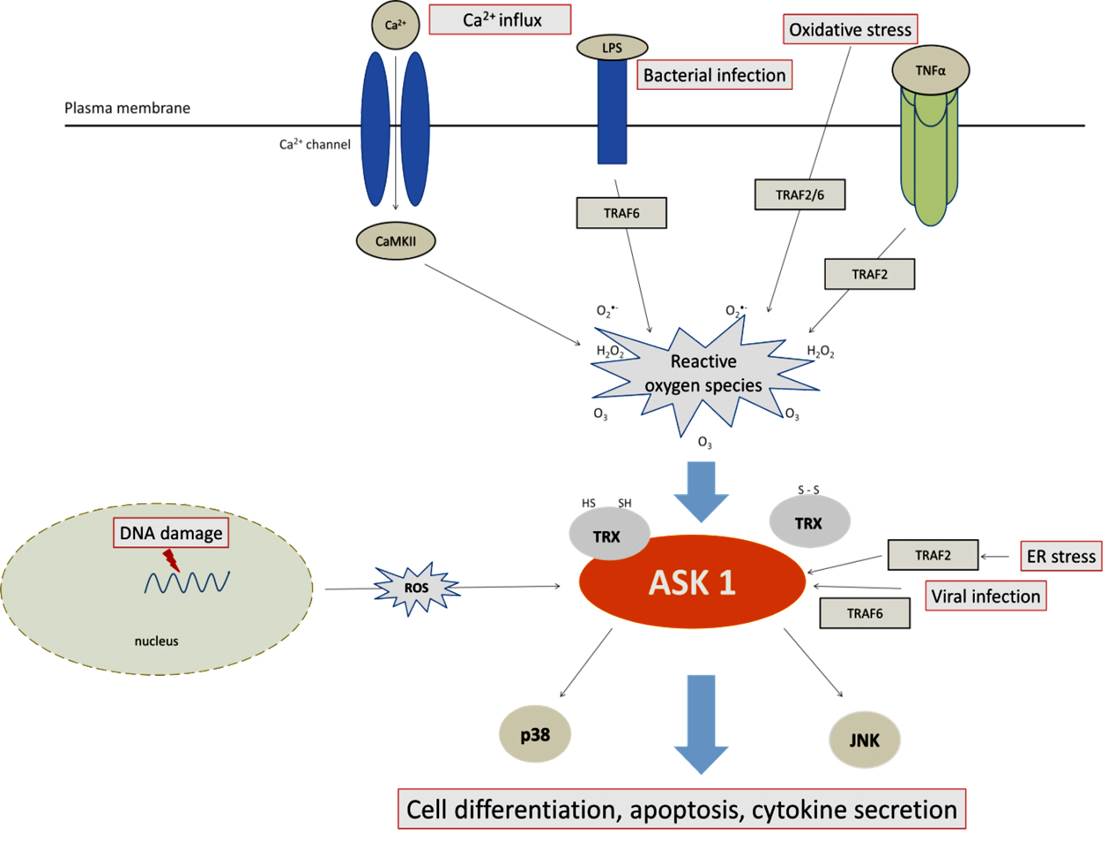
ASK1 kinasa je aktivována různými podněty jako je oxidativní stres, ER stres atd. Mezi její aktivátory patří TRAF2, TRAF6 a CaMKII. Mezi její inhibitory patří redoxní protein thioredoxin (TRX), který se v redukovaném stavu váže na N-konec ASK1 kinasy a inhibuje tak její aktivitu.
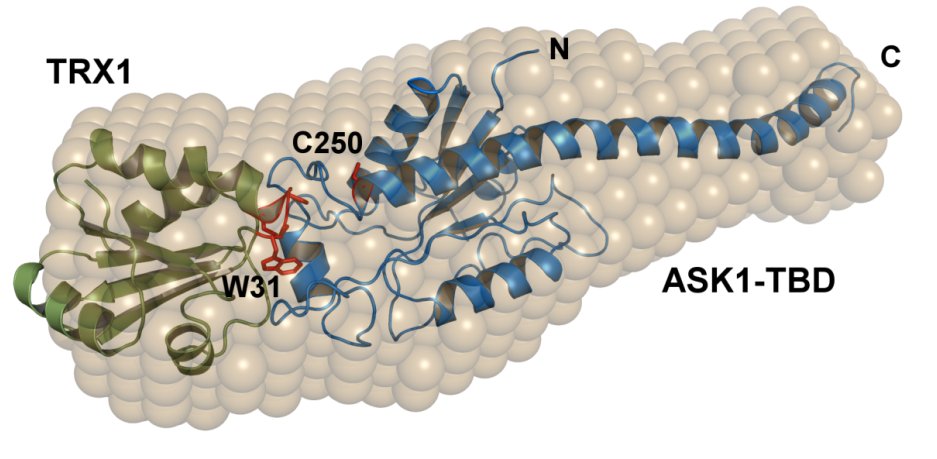
Superpozice obálky obdržené ze SAXS měření s teoretickým modelem komplexu ASK1-TBD s thioredoxinem (Kosek et al. 2014)
V letech 2015 - 2016 jsme pracovali na strukturní charakterizaci komplexu proteinu 14-3-3 s katalytickou doménou proteinkinasy ASK1 (ASK1-CD), abychom lépe porozuměli úloze této interakce v regulaci aktivity ASK1. Co jsme zjistili? Pomocí SAXS měření a chemického zesítění jsme ukázali, že komplex pASK1-CD:14-3-3 je dynamický a konformačně heterogenní. Navíc strukturní analýza spolu s výsledky 31P NMR a časově rozlišené tryptofanové fluorescence naznačily, že protein 14-3-3 interaguje s kinasovou doménou ASK1 v těsné blízkosti jejího aktivního centra. To ukazuje, že tvorba komplexu by mohla snižovat přístupnost aktivního centra a/nebo ovlivňovat jeho strukturu (Petrvalska et al. 2016).
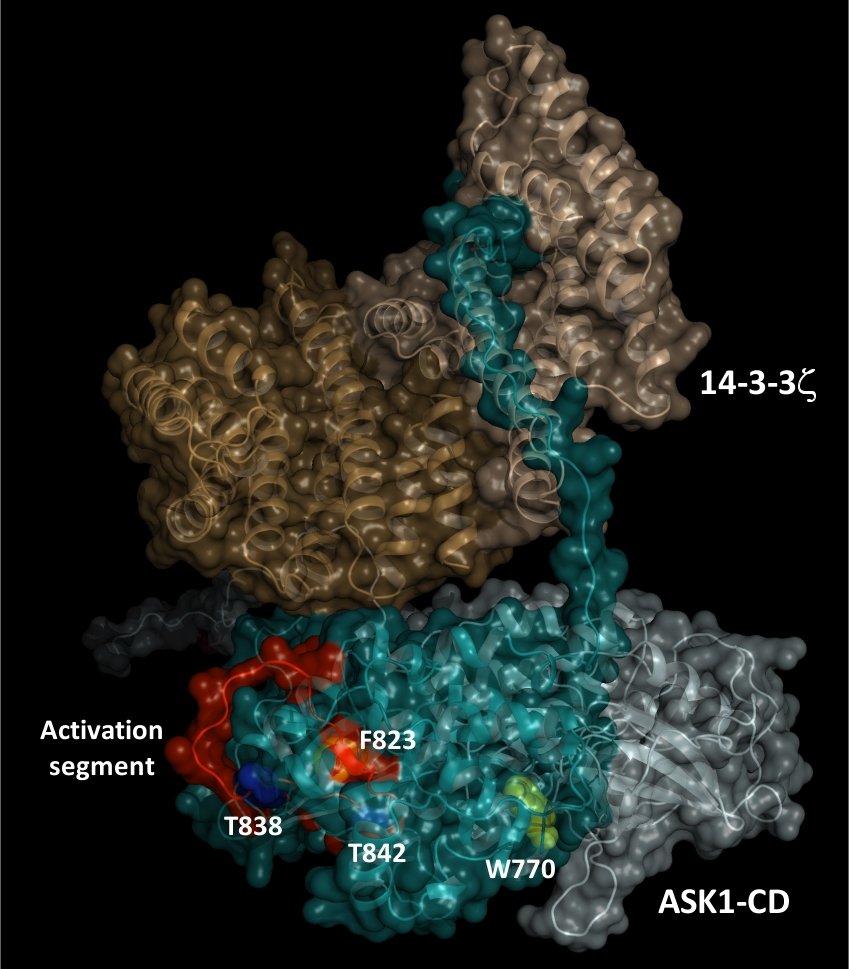
Superpozice obálky obdržené ze SAXS měření s teoretickým modelem komplexu ASK1-CD s proteinem 14-3-3 (Petrvalska et al. 2016)
