Teplotně citlivé iontové kanály TRP jsou buněčnými molekulárními senzory zapojenými v přenosu smyslových signálů, vnímání bolesti (nocicepci) a udržování iontové homeostázy. Poruchy jejich funkce jsou příčinou mnoha závažných lidských onemocnění, jako jsou chronická bolest, zánět, rakovina a různá kardiovaskulární, neurologická, respirační, ledvinová a metabolická onemocnění. Očekávání vkládaná do vývoje nových léčiv zaměřených na tyto kanály zatím zůstávají nenaplněná vzhledem k jejich schopnosti být aktivován podněty různých modalit (polymodalitě), jejíž mechanismus stále není zcela objasněn. Mezinárodní tým vědců vedených Prof. Peterem M. Zygmundem (Lund University, Malmö, Sweden) ve spolupráci s vědci z Fyziologického ústavu Akademie věd ČR v Praze objasnil dva důležité mechanismy přispívající k polymodální regulaci TRP kanálů. První studie odhalila vazebné místo a molekulární podstatu vazby D9‑tetrahydrocannabiorcolu (přírodního rostlinného kanabinoidu bez psychotropních účinků), který napomáhá aktivaci TRPV2, čímž ovlivňuje přenos bolestivých podnětů. Druhá studie identifikovala dvě samostatné specifické oblasti, které propůjčují jinému receptoru TRPA1 citlivost na teplo (> 35 °C) a chlad (< 15 °C), a prokázala, že teplotní citlivost tohoto receptoru rozhodujícím způsobem závisí na oxidačním a redukčním prostředí. Dosažené výsledky významně přispívají k pochopení obecných molekulárních mechanismů chemické a teplotní aktivace kanálů rodiny TRP a naleznou využití při hledání možných přístupů k jejich regulaci pomocí léčiv.
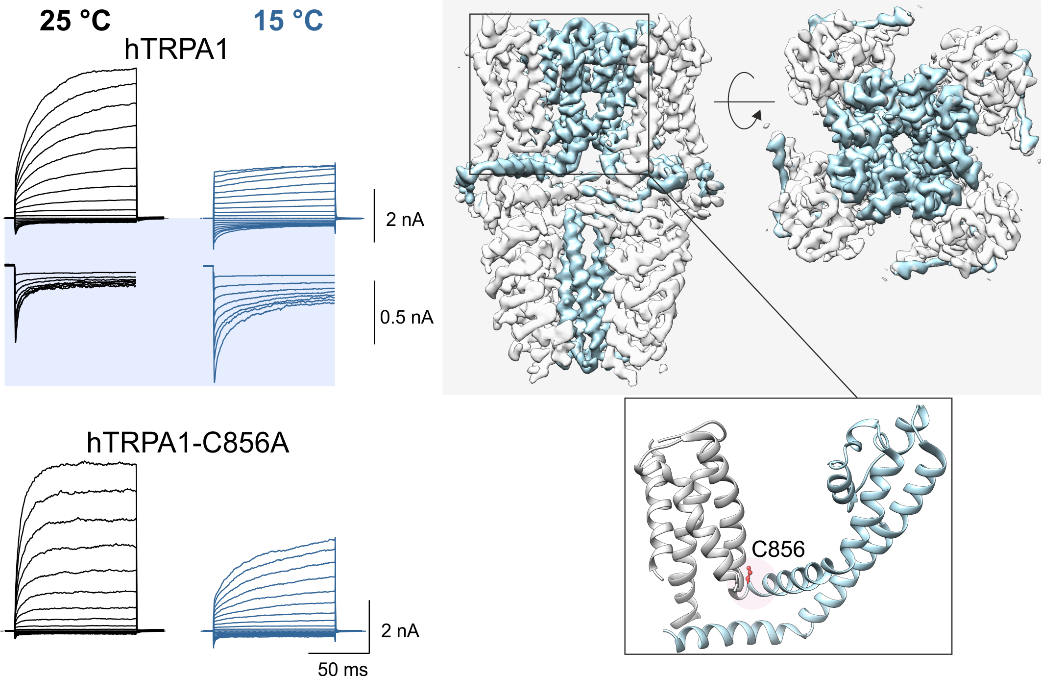
Vlevo: účinek chladu (15°C) na aktivaci lidského TRPA1 iontového kanálu přirozeného typu a mutantu, ve kterém je zaměněn hlavní aminokyselinový zbytek C856 zodpovědný za regulaci oxidačními a redukčními látkami. Kanály byly aktivovány sérií napěťových pulzů (od ‑160 mV do +200 mV).Vpravo: vizualizace struktury TRPA1 kanálu získaná kryoelektronovou mikroskopií (PDB: 6v9w) při pohledu ze strany a shora. Dynamické oblasti kanálu zodpovědné za aktivaci chladem jsou vyznačeny světle modrou barvou. Pozice cysteinu C856 je zobrazena na detailu struktury jedné podjednotky dole.
Moparthi, L. – Sinica, Viktor – Moparthi, V. K. – Kreir, M. – Vignane, T. – Filipovic, M. R. – Vlachová, Viktorie – Zygmunt, P. M.The human TRPA1 intrinsic cold and heat sensitivity involves separate channel structures beyond the N-ARD domain. Nature Communications. Roč. 13, č. 1 (2022), IF: 17.694 DOI
Zhang, L. – Simonsen, Ch. – Zímová, Lucie – Wang, K. – Moparthi, L. – Gaudet, R. – Ekoff, M. – Nilsson, G. – Hellmich, U. A. – Vlachová, Viktorie – Gourdon, P. – Zygmunt, P. M. Cannabinoid non-cannabidiol site modulation of TRPV2 structure and function. Nature Communications. Roč. 13, č. 1 (2022), IF: 17.694, rok: 2021 DOI