Transkripční faktor p53 je klíčovým regulátorem apoptózy, senescence a opravy DNA, který chrání buňky před nádorovým bujením při různých buněčných stresech. Funkce p53 jsou úzce propojeny s funkcí s aktivitou transkripčních faktorů FOXO (Forkhead box O).
Biofyzikální studie
V této práci charakterizujeme interakci mezi p53 a FOXO4 pomocí NMR, chemického síťování a analytické ultracentrifugace.Naše výsledky ukazují, že interakce mezi p53 TAD a FOXO4 Forkhead doménou je nezbytná pro celkovou stabilitu komplexu p53:FOXO4. Navíc kontakty zahrnující N-terminální segment FOXO4, C-terminální negativní regulační doménu p53 a DNA-vazebné domény obou proteinů stabilizují komplex, jehož vznik blokuje vazbu p53 na DNA, ale bez ovlivnění DNA-vazebných vlastností FOXO4. Naše strukturní zjištění proto mohou pomoci pochopit vzájemně provázané funkce p53 a FOXO4 v buněčné homeostáze, dlouhověkosti a odpovědi na stres.
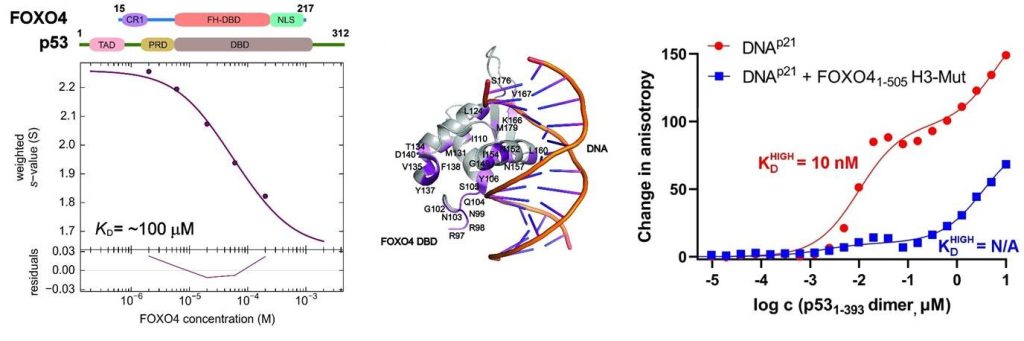
Vlevo analýza interakce mezi FOXO4 a p53 pomocí analytické ultracentrifugace sedimentační rychlosti. Uprostřed chemické posuny získané z 1H-15N HSQC spekter FOXO4 značeného 15N v přítomnosti p53 mapované na krystalovou strukturu komplexu FOXO4 DBD:DNA. Vpravo měření fluorescenční anizotropie ukazující, že tvorba komplexu snižuje afinitu p53 k vazbě na DNA (Mandal et al. (2022) Protein Science).