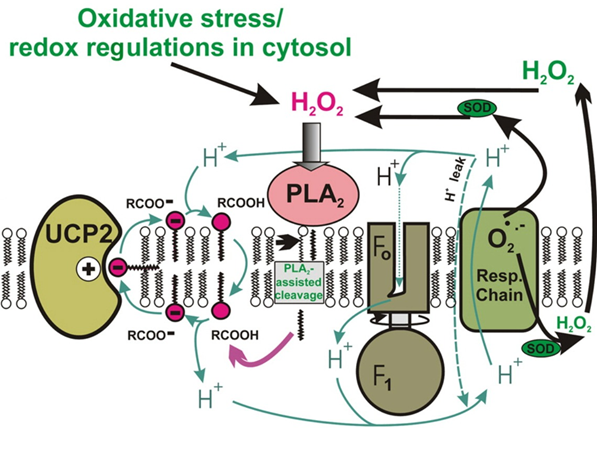
Úloha mitochondriální fosfolipázy A2 (PLA2) a odpřahujících proteinů v ochraně před oxidačním stresem za fyziologických podmínek
Mitochondriální odpřahující proteiny (UPCs) se podílejí na disipaci protonmotivní síly a související mírné odpřažení buněčného dýchání je spojeno se snížením produkce reaktivních forem kyslíku (ROS). Volné mastné kyseliny jsou nezbytné pro funkci UCPs jako cyklické substráty. Fosfolipázy nezávislé na vápníku (iPLA2) jsou rodina enzymů, o kterých je známo, že se podílejí na buněčné signalizaci tím, že současně produkují volné mastné kyseliny a lysofosfolipidy. V naší laboratoři studujeme spojení mezi mitochondriálními odpřahujícími proteiny a mitochondriálními fosfolipázami. Testujeme hypotézu, že mírný oxidační stres indukuje činnost iPLA2 a iniciuje odpřažení závislé na UCP2, které vede k poklesu produkce ROS. Naše dosavadní výsledky jsou v souladu s přítomností redoxně regulované mitochondriální iPLA2 a podporují výše nastíněnou hypotézu konzistentní s UCP2-závislým zpětnovazebným útlumem oxidačního stresu.
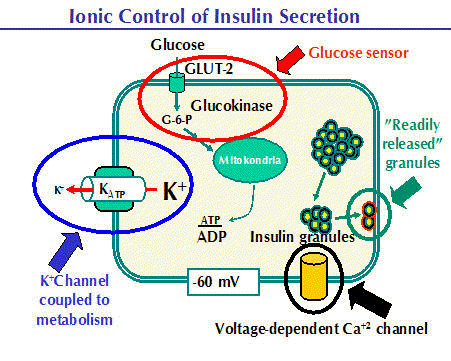
Úloha redoxní rovnováhy při glukózou indukovaném výlevu insulinu u β buněk Langerhansových ostrůvku pankreatu
β-buňky Langerhansových ostrůvků pankreatu jsou životně důležité pro udržení hladiny cukru v těle organismu. Β-buňky po detekci zvýšené glukózy v krvi iniciují výlev insulinu. Učebnicový mechanismus výlevu insulinu začíná na plasmatické membráně, kde glukozový přenašeč importuje glukózu, která je dalšími reakcemi glykolytické dráhy přeměněna na pyruvát, který slouží jako substrát pro mitochondrii, pro následnou výrobu ATP. Zvýšená hladina ATP/ADP v buňce pak inhibuje KATP senzitivní kanál na plasmatické membráně, dochází k depolarizaci membrány a vtoku vápníku zejména přes L-typ vápníkového kanálu. Zvýšení vnitrobuněčného vápníku způsobí uvolnění insulinových částic do krevního řečiště.
(zdroj: http://www.medbio.info/horn/time%203-4/secretion_of_insulin_and_glucagon.htm)
Jelikož signalizace výlevu inzulinu prochází přes mitochondrie a mitochondrie jsou jedním z největších iniciačních zdrojů kyslíkových radikálů, na který reagují cytoplasmatické redoxní rovnováhy, hraje vnitrobuněčná redoxní homeostáza významnou úlohu při výlevu inzulinu. Zjistili jsme, že po přídavku glukózy dochází ke značné oxidaci vnitrobuněčného prostředí. Cílem projektu je zjistit prooxidační zdroj a mechanismus jeho regulace výlevu insulinu. Tato znalost je klíčovou pro porozumění porušení redoxní homeostáze u cukrovky 2. typu.
Úloha mitochondriálního metabolismu, zejména redoxní regulace v chronickou hypoxií indukované plicní hypertenzi
Plicní hypertenze (PH) je komplexní onemocnění, které vede k poškození srdce a předčasnému úmrtí pacientů. PH je charakterizována výraznou remodelací stěny periferních plicních tepen doprovázenou zánětem, které způsobují nárůst lokálního krevního tlaku. PH je výsledkem několikastupňového procesu, jenž je zřejmě důsledkem přeprogramování celkové genové exprese v buňce. V souladu s nejnovějšími pozorováními, že PH sdílí klíčové faktory se vznikem nádorových onemocnění, jsme zjistili, že arteriální fibroblasty izolované z novorozených telat, u kterých byla PH indukována chronickou hypoxií, vykazují vysoce aktivní pro-růstový a pro-zánětlivý fenotyp. Cílem tohoto projektu je zjistit jaké metabolické změny probíhají v těchto fibroblastech, ale i hladkosvalových buňkách arteriální stěny s důrazem na bioenergetiku buňky a mitochondrií a případné související regulace. Toto téma je řešeno v rámci spolupráce s Prof. Kurtem R. Stenmarkem (University of Colorado, Denver).
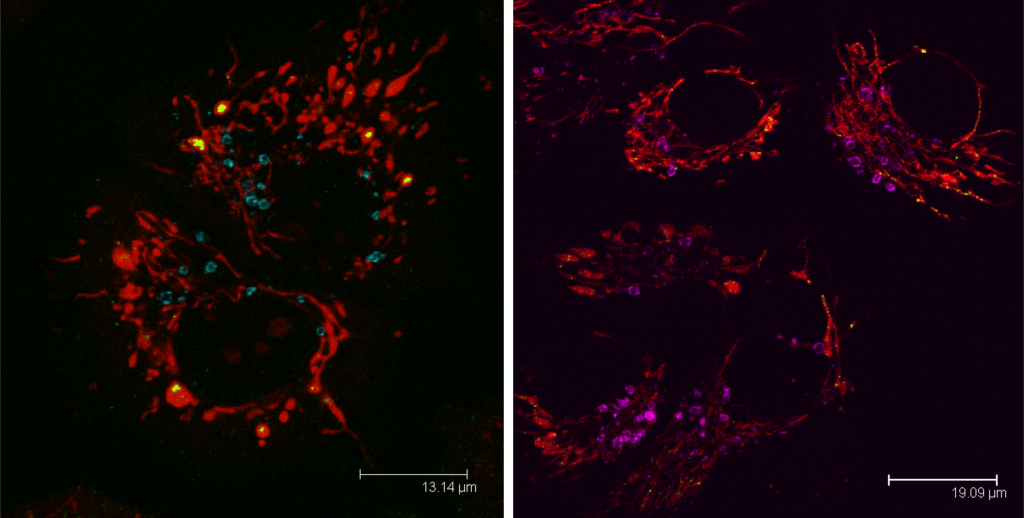
Mitofagie jako důsledek cukrovky 2. typu
Autofagie (v doslovném překladu z řečtiny „sebepojídání“) se významným způsobem podílí na obratu inzulínu resp. inzulínových sekrečních granulí. Je známo, že pouze malá část inzulínových granulí je β-buňkami Langerhansových ostrůvků secernována a větší část zústává retinována jako zásobní hotovost. Poločas stability takových zásobních granulí je však pouze cca 3–5 dní a ty jsou pak degradovány i pomocí procesů a enzymatických kaskád spojených s autofagií. Autofagie se tak spolu s dalšími „intracelulárními očistnými procesy“ významně podílí na vyvážení glukózou stimulované inzulínové produkce a jeho následné sekrece. Je známo, že látky, které v různých fázích stimulují nebo naopak blokují autofagii, mohou vyvolat diabetes (např. rapamycin). Proto je velmi pravděpodobné, že i další vnější nebo vnitřní zásahy do dynamické rovnováhy tohoto procesu se uplatňují při vzniku tohoto dnes již populačního onemocnění, provázeného smrtelnými komplikacemi. Do jaké míry se se při vzniku diabetu vzájemně prolínají a ovlivňují procesy specifické autofagie inzulínových granulí a s autofagií dalších buněčných organel jako jsou například mitochondrie (mitofagie) je předmětem našeho výzkumu.
Mitofagie probíhající v buňce zobrazená pomocí anti-LAMP1 protilátky (LAMP1 modrá, fialová; mitochondrie červená, mtDNA zelená).