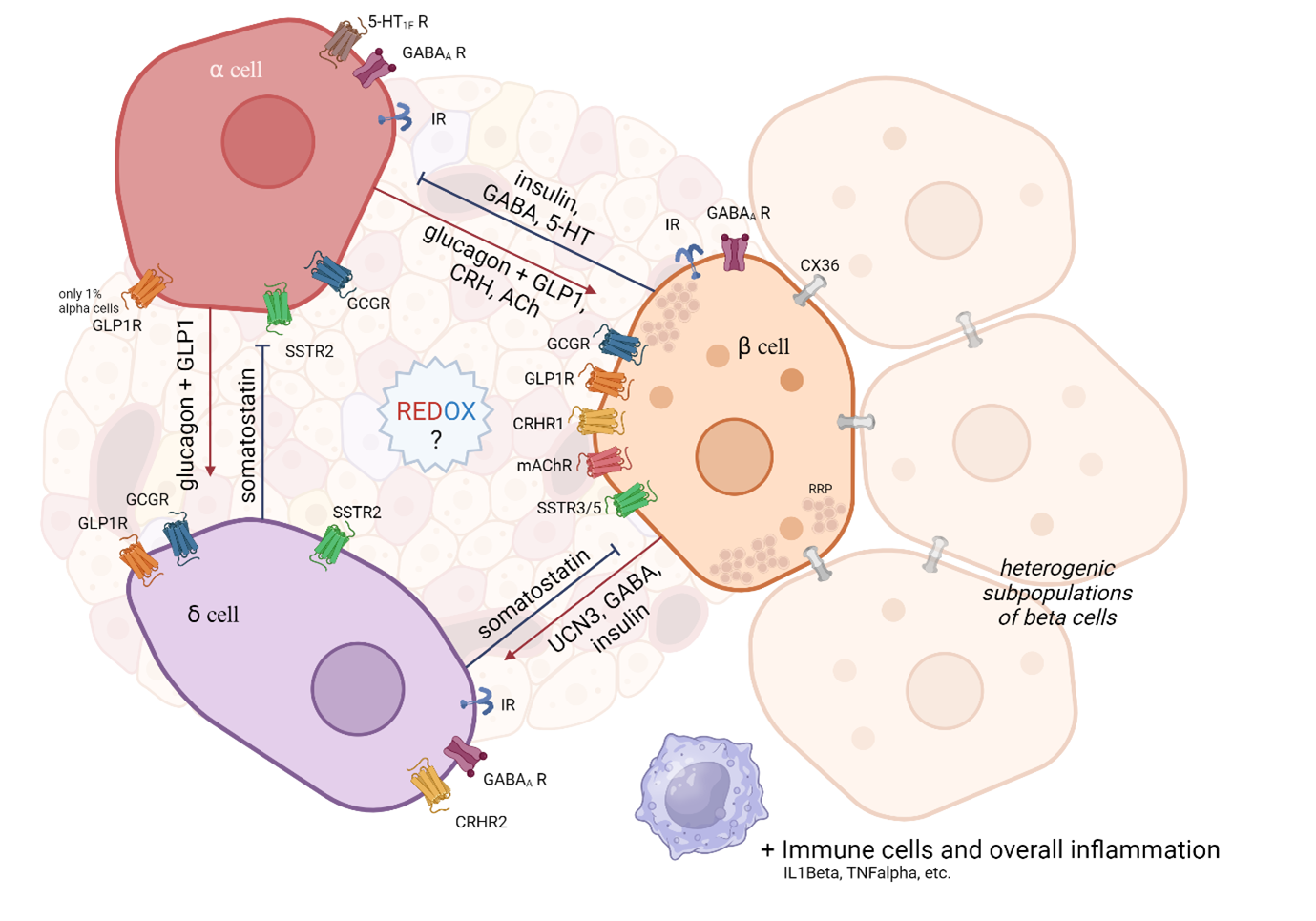
Cílem tohoto projektu je pochopit, jak narušení redoxního stavu přispívá k dysfunkci buněk ostrůvků a k rozvoji metabolických poruch, jako je diabetes 2. typu. Zatímco o dysfunkci beta-buněk v diabetu je toho známo mnoho, role ostatních endokrinních buněk v rozvoji metabolických onemocnění zůstává dosud málo objasněna. Zaměřujeme se na roli redoxního stavu v mezibuněčné komunikace uvnitř pankreatických ostrůvků. Ty jsou tvořeny zejména třemi typy endokrinních buněk: alfa (produkce glucagonu), beta (produkce inzulinu) a delta (produkce somatostatinu).
Použité zkratky: IR – Inzulinový receptor, GCGR – Glukagonový receptor, GLP1R- Receptor pro glukagonu podobný peptid 1, SSTR – Somatostatinový receptor (izoformy 2,3,5), GABA? R -Receptor pro GABA typu A (inhibiční neurotransmiter), 5-HT1F R – Serotoninový receptor typu 1F, CRHR – Receptor pro kortikotropin uvolňující hormon, mAChR – Muskarinový acetylcholinový receptor, CX36 – Connexin 36, RRP – „Ready releasable pool“ (připravené zásoby sekrečních granul)
Pro správnou regulaci hladiny glukózy v krvi je nezbytná správná komunikace uvnitř ostrůvku (parakrinní a autokrinní) i komunikace s periferními tkáněmi (inkretiny z trávicí soustavy, nervová soustava, imunitní soustava etc.). Alfa, beta i delta buňky spolu komunikují pomocí vlastních hormonů a dalších signálních látek (viz. obrázek) působením přes specifické receptory na povrchu cílových buněk. Největší pozornost věnujeme majoritní beta buněčné populaci. Ta se dále rozděluje na další subpopulace, např. „pacemaker-like Hubbovy“ buňky vytvářející vlnu akčního potenciálu, která vyvolá synchronní výlev z okolních buněk přes mezerové spoje (CX36).
Výlev inzulinu z beta buněk je stimulovaný zvýšeným metabolismem glukózy, který vede ke změnám v redoxním prostředí a reverzibilním modifikacím citlivých proteinů (oxidace, acetylace, fosforylace) (Holendova et al., 2024). Studujeme zejména hlavní beta buněčný zdroj reaktivních forem kyslíku (ROS) enzym NADPH oxidázu 4 (NOX4), která byla popsána jako klíčový zesilovač signálu při glukózou stimulovaném výlevu inzulinu (Plecita-Hlavata et al., 2020). Nerovnováha v redoxním prostředí je spojená s poruchami funkce beta buněk. Delece Nox4 u beta specifických Nox4-/- mutantních myší vede k pro-redukčnímu fenotypu. Tyto myši vykazují poruchu dvoufázového výlevu inzulinu a periferní inzulinovou rezistenci. Naopak chronicky zvýšená aktivita NOX4 a pro-oxidační prostředí beta buněk vlivem metabolického stresu vede k nárůstu systémového zánětu, např. při dietě s vysokým obsahem tuků (Holendova et al, 2024). Zatím není zcela jasné, jakou roli v rozvoji zdravotních komplikací hrají ostatní endokrinní buňky. Jejich úloha v dospělosti je zejména důležitá během vývoje diabetu 2. typu, kdy dochází k různým kompenzačním mechanismům, které dosud nebyly zcela popsány.
Reference:
Holendová B, Šalovská B, Benáková Š, Plecitá-Hlavatá L. Beyond glucose: The crucial role of redox signaling in β-cell metabolic adaptation. Metabolism 2024;161:156027.
Lydie Plecitá-Hlavatá, Martin Jabůrek, Blanka Holendová, Jan Tauber, Vojtěch Pavluch, Zuzana Berková, Monika Cahová, Katrin Schröder, Ralf P. Brandes, Detlef Siemen, Petr Ježek; Glucose-Stimulated Insulin Secretion Fundamentally Requires H2O2 Signaling by NADPH Oxidase 4. Diabetes 1 July 2020; 69 (7): 1341–1354. https://doi.org/10.2337/db19-1130
Holendová B, Benáková Š, Křivonosková M, Pavluch V, Tauber J, Gabrielová E, Ježek P, Plecitá-Hlavatá L. NADPH oxidase 4 in mouse β cells participates in inflammation on chronic nutrient overload. Obesity (Silver Spring) 2024;32:339-351.