Bioenergetika

Na této straně najdete
O oddělení
Studujeme fyziologii mitochondrií – hlavních producentů energie v buňkách na molekulární úrovni. Využíváme jak zvířecích modelů, tak buněk pacientů s různými dědičnými mitochondriálními poruchami. Zabýváme se především výzkumem v těchto oblastech:
- Studium tvorby mitochondriálních proteinových komplexů a superkomplexů.
- Studium lidských dědičných chorob způsobených mutacemi v proteinech podílejících se na sestavování těchto enzymových komplexů.
- Vývoj metodiky pro diagnostiku mitochondriálních poruch ve vzorcích lymfocytů od pacientů.
- Hledání nových mitochondriálních genů podílejících se na rozvoji metabolického syndromu a srdečního selhání.
Zajímá vás, jak to u nás vypadá? Takhle naše oddělení viděla stážistka Otevřené vědy Eva G.
Projekty
Publikace
Mlejnek; Petr - Šimáková; Miroslava - Šilhavý; Jan - Houštěk; Josef - Marková; I. - Hüttl; M. - Malínská; H. - Pravenec; Michal Nrf2 Overexpression in Spontaneously Hypertensive Rats Enhances Adipose Tissue Metabolism through Redox-Mediated Suppression of Mitochondrial Oxidative Phosphorylation. Physiological Research. 2025; 74(6); 923-934.
IF = 2
Líblová; Zuzana - Maurencová; Dominika - Šalovská; Barbora - Krátký; Marek - Mráček; Tomáš - Korandová; Zuzana - Pecinová; Alena - Vašicová; Pavla - Ryšánek; David - Anděra; Ladislav - Fabrik; I. - Kupčík; R. - Kashmel; Pavel - Sultana; Pinky - Tambor; V. - Bártek; Jiří - Novák; Josef - Vajrychová; M. - Hodný; Zdeněk Determination of ADP/ATP translocase isoform ratios in malignancy and cellular senescence. Molecular Oncology. 2025; 19(9); 2619-2647.
IF = 4.5
Zimolová; Veronika - Burocziová; Monika - Berková; Linda - Grušanovič; Srdjan - Gursky; J. - Janotka; M. - Kašpárek; Petr - Pecinová; Alena - Kundrát; D. - Hrčkulák; Dušan - Onhajzer; Jakub - Ježíšková; R. - Nekvindová; L. - Weinbergerová; B. - Pospíšilová; S. - Doubek; M. - Alberich-Jorda; Meritxell - Kořínek; Vladimír - Divoký; V. - Láníková; Lucie Germline Jak2-R1063H mutation interferes with normal hematopoietic development and increases risk of thrombosis and leukemic transformation. Leukemia. 2025; 39(11); 2745-2757.
IF = 13.4
Šimoník; Ondřej - Bryndová; Barbora - Sur; Vishma Pratap - Děd; Lukáš - Čočková; Z. - Benda; A. - Qasemi; Maryam - Pecina; Petr - Pecinová; Alena - Spěváková; Daniela - Škrobánek; P. - Hradec; T. - Ezrová; Zuzana - Krátká; Z. - Křen; R. - Ješeta; M. - Boublíková; L. - Zámečník; L. - Büchler; T. - Neužil; Jiří - Postlerová; Pavla - Komrsková; Kateřina Bioenergetics of human spermatozoa in patients with testicular germ cell tumours. Molecular Human Reproduction. 2025; 31(1); gaaf005.
IF = 3.5
Alán; Lukáš - Opletalová; Barbora - Hayat; Habiba - Marković; Aleksandra - Hlaváčková; Markéta - Vrbacký; Marek - Mráček; Tomáš - Alánová; Petra Mitochondrial metabolism and hypoxic signaling in differentiated human cardiomyocyte AC16 cell line. American Journal of Physiology-Cell Physiology. 2025; 328(5); C1571-C1585.
IF = 4.7
Korandová; Zuzana - Pecina; Petr - Pecinová; Alena - Koňaříková; Eliška - Tesařová; M. - Houštěk; Josef - Hansíková; H. - Ptáčková; H. - Zeman; J. - Honzík; T. - Mráček; Tomáš Cryopreserved PBMCs can be used for the analysis of mitochondrial respiration and serve as a diagnostic tool for mitochondrial diseases. Analytical Biochemistry. 2025; 698(March); 115745.
IF = 2.5
Úspěchy
MITOCHONDRIÁLNÍ GENY A ROZVOJ RESISTENCE K INZULINU
Obezita, vysoká hladina cukru v krvi nebo inzulinová rezistence patří mezi nejčastější příznaky metabolického syndromu. Jeho dědičné příčiny však zatím nejsou zcela objasněny. Vědci z laboratoře Bioenergetiky Fyziologického ústavu AV ČR a Národního institutu CarDia zjistili, že důležitou roli při rozvoji příznaků metabolického syndromu by mohla hrát variabilita DNA v mitochondriích.
Reference: Pecina P., Čunátová K., Kaplanová V., Puertas-Frias G., Šilhavý J., Tauchmannová K., Vrbacký M., Čajka T., Gahura O., Hlaváčková M., Stránecký V., Kmoch S., Pravenec M., Houštěk J., Mráček T., Pecinová A.: Haplotype variability in mitochondrial rRNA predisposes to metabolic syndrome. Communications Biology 7(1):1116 (2024). DOI
TMEM70 onemocnění
Zvířecí modely lidských mitochondriálních onemocnění umožňují detailně mapovat patogenní mechanismy, od molekulární úrovně po celý organismus. Více
Mitochondriální dysfunkce a Fanconiho syndrom
Vrozené poruchy energetické funkce dýchacího řetězce mitochondrií jsou příčinou celé řady závažných onemocnění, od nejtěžších encefalo-kardio-myopatií s nástupem příznaků záhy po narození až po tkáňově specifická onemocnění s mírnějším průběhem a nástupem v dospělosti. Více
Jak zpomalit stárnutí?
Projevy stárnutí jsou částečně přičítány hromadění poškození „volnými kyslíkovými radikály“ v průběhu života. Naše výsledky nyní ukazují, že tvorbu škodlivých „volných kyslíkových radikálů“ nelze zastavit tak, jak jsme dlouho předpokládali.
Jako jediná živočišná skupina disponují savci hnědou tukovou tkání, termogenním orgánem, který zejména u novorozenců brání prochladnutí. K aktivaci této tkáně proto dochází především při adaptaci na chlad. Produkci tepla zde zajišťuje protein označovaný jako UCP1 (z anglického názvu uncoupling protein 1).
Hnědá tuková tkáň je pro své unikátní vlastnosti a přítomnost výlučně u savců v našem ústavu intenzivně studována. Na podzim zde na webu o svých výsledcích informovali naši kolegové z Oddělení biologie tukové tkáně, kteří zkoumali vliv žlučových kyselin v potravě na zvýšení energetického výdeje prostřednictvím hnědého tuku, čímž dochází ke snížení rizika vzniku obezity (článek si můžete přečíst zde).
Stejný mechanismus, kterým dochází k produkci tepla a tím výdeji energie v hnědé tukové tkáni, by však mohl mít ještě další uplatnění – snížení produkce škodlivých „volných kyslíkových radikálů“ (odborně reaktivních forem kyslíku, zkráceně ROS – z anglického reactive oxygen species). ROS poškozují naše buňky a tkáně, a tak se podílejí na jejich přirozeném stárnutí.
My jsme se ve spolupráci s vědci ze Stockholmu (Prof. Cannon) pokusili objasnit úlohu UCP1 při tvorbě ROS v hnědé tukové tkáni, přičemž jsme srovnávali myš bez funkčního proteinu UCP1 s myší zdravou. Výsledky naznačují, že naděje ani peníze vkládané do UCP1 jako ochránce před škodlivými ROS nemusí být namířeny tím správným směrem. Ukázalo se, že aktivita proteinu UCP1 nemá žádný vliv na snížení produkce ROS za fyziologických podmínek, alespoň v hnědé tukové tkáni. Navíc jsme zjistili, že při chladové adaptaci, kdy jsou myši trvale chovány při 4 °C, sice dochází k aktivaci hnědého tuku a nárůstu obsahu a aktivity UCP1, ale zároveň se zvyšuje produkce ROS ve srovnání s myší s nefunkčním UCP1. Přitom očekávání byla přesně opačná. Pokud se tato pozorování potvrdí i v dalších tkáních, bude nutné hypotézu o blahodárném účinku UCP1 na buněčné stárnutí přehodnotit a hledat jiný způsob, jak snížit tvorbu ROS v našem těle.
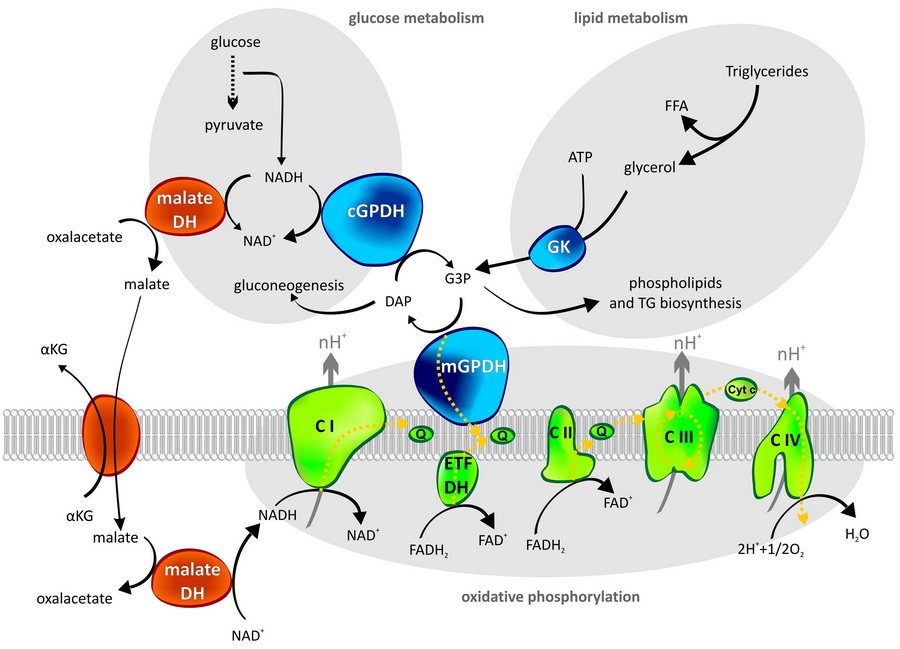
Kyslíkové radikály a mitochondriální glycerol-3-fosfát dehydrogenáza
Když zapálíte oheň, nehoří nikdy dokonale a důsledkem je stoupající kouř. Podobně ani buněčné dýchání nefunguje na 100 %. Vedlejším produktem jsou zde reaktivní formy kyslíku, zvané také kyslíkové radikály (reactive oxygen species, ROS).
Bývá jim připisována negativní úloha v rozvoji mnoha onemocnění stejně jako v procesu stárnutí. Doposud však u mnoha enzymů, které ROS produkují, vědci neznají přesný mechanizmus, jak k jejich vzniku dochází. Přitom poznání mechanizmu je důležitým předpokladem pro případné hledání látek s terapeutickým účinkem. K porozumění detailů tohoto procesu u jednoho z enzymů – mitochondriální glycerol-3-fosfát dehydrogenázy – jsme nedávno přispěli i my. Celý článek si můžete přečíst v prestižním časopise BBA Bioenergetics.
Tomáš Mráček, Eliška Holzerová, Zdeněk Drahota, Nikola Kovářová, Marek Vrbacký, Pavel Ješina, Josef Houštěk: ROS generation and multiple forms of mammalian mitochondrial glycerol-3-phosphate dehydrogenase
Mitochondriální glycerol-3-fosfát dehydrogenáza
Tento enzym propojuje metabolizmus sacharidů a lipidů s mitochondriálním respiračním řetězcem. Představuje jednu z možných drah, kterou dochází k přenosu redukčních ekvivalentů z cytosolu do mitochondrií. Jedná se o tzv. glycerolfosfátový člunek, který vytvářejí dva enzymy – mitochondriální (mGPDH) a cytosolická (cGPDH) glycerol-3-fosfát dehydrogenáza. Druhou cestu redukčních ekvivalentů do mitochondrií pak představuje rozšířenější člunek malát-aspartátový.