Bioenergetika
Na této straně najdete
O oddělení
Studujeme fyziologii mitochondrií – hlavních producentů energie v buňkách na molekulární úrovni. Využíváme jak zvířecích modelů, tak buněk pacientů s různými dědičnými mitochondriálními poruchami. Zabýváme se především výzkumem v těchto oblastech:
- Studium tvorby mitochondriálních proteinových komplexů a superkomplexů.
- Studium lidských dědičných chorob způsobených mutacemi v proteinech podílejících se na sestavování těchto enzymových komplexů.
- Vývoj metodiky pro diagnostiku mitochondriálních poruch ve vzorcích lymfocytů od pacientů.
- Hledání nových mitochondriálních genů podílejících se na rozvoji metabolického syndromu a srdečního selhání.
Zajímá vás, jak to u nás vypadá? Takhle naše oddělení viděla stážistka Otevřené vědy Eva G.
Projekty
Úspěchy
TMEM70 onemocnění
Zvířecí modely lidských mitochondriálních onemocnění umožňují detailně mapovat patogenní mechanismy, od molekulární úrovně po celý organismus. Více
Mitochondriální dysfunkce a Fanconiho syndrom
Vrozené poruchy energetické funkce dýchacího řetězce mitochondrií jsou příčinou celé řady závažných onemocnění, od nejtěžších encefalo-kardio-myopatií s nástupem příznaků záhy po narození až po tkáňově specifická onemocnění s mírnějším průběhem a nástupem v dospělosti. Více
Věda fotogenická 2017 zná své viítěze - a je mezi nimi i naše oddělení
Letošní již čtvrtý ročník soutěže Věda fotogenická přinesl opět množství užasných fotografií a tentokrát jsme se radovali i my.
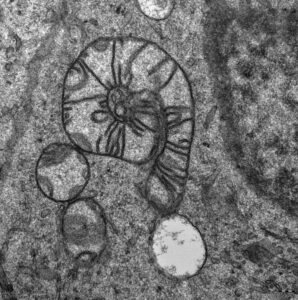
Nejlepší fotografií v kategorii On-line hlasování si odnesl snímek MitoŠnek, jehož autorem je Mgr. Lukáš Alán, Ph.D. z oddělení bioenergetiky Fyziologického ústavu AV ČR a Mgr. Marie Rodinová z 1. LF UK. Gratulujeme! Úplný přehled oceněných prací si můžete prohlédnout ZDE nebo do 17.11.2017 v budově AV na Národní třídě.
Název snímku: Mitošnek
Autoři snímku Lukáš Alán (FGÚ AV ČR) a Marie Rodinová (1.LF UK)
Savčí mitochondrie stočená do podoby šneka a zachycená elektronovým mikroskopem.
Fotografie byla pořízena z kontrolní HEK 293 buněčné linie.
Naše nová publikace: Vysoká odolnost buněk vůči mitochondriálním mutacím
Vyvíjející se organismus potřebuje velké množství energie ve formě ATP. U vyšších eukaryot, a tedy i u člověka, je více než 90 % potřebného ATP produkováno v mitochondriích, které obecně představují klíčovou organelu buněčného katabolismu. Není tedy překvapivé, že mitochondriální poruchy patří mezi časté příčiny metabolických onemocnění u dětské populace.
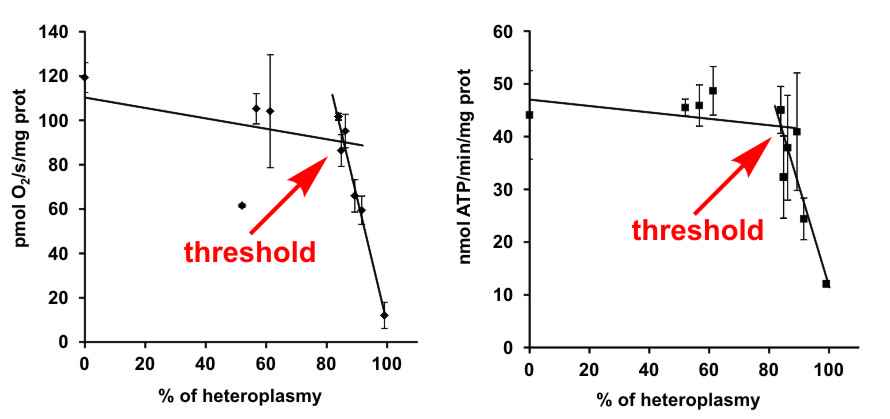
ATP syntáza sdílí s dalšími enzymy oxidační fosforylace jednu unikátní vlastnost, a sice že její podjednotky jsou kódovány jak DNA v jádře, tak i DNA obsaženou přímo v mitochondriích (mtDNA). Mutace v jaderné i mitochondriální DNA se pak mohou manifestovat jako dědičná onemocnění. Klinické obrazy u mtDNA pacientů bývají různé, od lehčích svalových dysfunkcí až po velmi závažná onemocnění mozku a srdce. I u pacientů se stejnou mutací je možné nalézt řadu rozdílných symptomů, a to i u sourozenců, kde je vliv jaderného pozadí minimální. Hlavním faktorem ovlivňujícím závažnost těchto onemocnění je takzvaná heteroplazmie, která vyjadřuje procentuální zastoupení mutované mtDNA relativně ke zdravé, nemutované. V letošním roce jsme opublikovali studii provedenou na modelu vzácné mutace v mitochondriálním genu MT-ATP6, která vede k defektu hned dvou enzymů oxidační fosforylace: cytochrom c oxidázy a ATP syntázy. Ukázali jsme, že i přesto, že se jedná o dva klíčové enzymy tvorby ATP v savčí buňce, pro biochemický projev mutace a rozvoj závažných příznaků onemocnění je nezbytné, aby obsah mutované mitochondriální DNA překročil velmi vysokou prahovou hodnotu heteroplazmie okolo 90 %. Snahou publikace bylo přispět právě k objasnění vztahu mezi zastoupením mutace (hladinou heteroplazmie) a jejími klinickými příznaky. V tomto konkrétním případě se ukázalo, že závažnost projevů přímo odpovídá množství přítomných podjednotek jednotlivých enzymů a ke vzniku prahového efektu dochází na úrovni překladu gen/protein.
Hejzlarová K, Kaplanová V, Nůsková H, et al. Alteration of structure and function of ATP synthase and cytochrome c oxidase by lack of Fo-a and Cox3 subunits caused by mitochondrial DNA 9205delTA mutation. Biochem. J. 2015;466:601–611.
Naše publikace v roce 2014
Minulý rok jsme byli tak zaneprázdněni přípravou nových publikací, že jsme úplně zapomněli se jimi pochlubit. Zde je alespoň krátké ohlédnutí za tím, co jsme v roce 2014 dělali.
ATP SYNTÁZA, KLÍČOVÝ ENZYM MITOCHONDRIÁLNÍ ENERGETIKY A JEHO DEFEKTY
Dlouhodobě nás zajímá bioenergetika dědičných metabolických poruch, a to především defektů enzymu klíčového pro produkci energie – ATP syntázy. Detailně proto zkoumáme sestavování tohoto enzymového komplexu, který se skládá z několika různých podjednotek a jehož sestavování se účastní řada pomocných proteinů. Jedním z nich je protein TMEM70, na jehož objevu se naše laboratoř podílela (Čížková et al. 2008). Naše nejnovější výsledky týkající se proteinu TMEM70 ukazují, že tento protein ve vnitřní mitochondriální membráně zaujímá strukturu dvou transmembránových helixů spojených smyčkou s N- i C-koncem směřujícím do matrix mitochondrií. Rovněž se nám podařilo ukázat, že TMEM70 vytváří dimery i vyšší oligomery, ale při hledání jiných interakčních partnerů jsme zatím nebyli úspěšní. Jelikož se nám nepodařilo najít přímou interakci s ATP syntázou, nemůžeme vyloučit, že role proteinu TMEM70 v sestavování ATP syntázy může být zprostředkována dalšími proteiny.
Kratochvílová H, Hejzlarová K, Vrbacký M, et al. Mitochondrial membrane assembly of TMEM70 protein. Mitochondrion. 2014;15:1-9.
K tématu dědičných poruch ATP syntázy jsme také napsali review, které vyšlo ve speciálním čísle časopisu Physiological Research vydaného při příležitosti oslav 60. výročí založení Fyziologického ústavu:
Hejzlarová K, Mráček T, Vrbacký M, et al. Nuclear genetic defects of mitochondrial ATP synthase. Physiol Res. 2014;63 Suppl 1:S57-S71.
SPONTÁNNĚ HYPERTENZNÍ POTKAN – NEJVÍCE ZKOUMANÝ KMEN LABORATORNÍHO POTKANA
Spontánně hypertenzní kmen potkana (SHR, spontaneously hypertensive rat) používáme jako model pro studium řady metabolických stavů.
Mutace v genu DSG4 kódujícím protein desmoglein 4 má za následek narození holého potkana bez srsti. Tohoto potkana jsme studovali jako model zvýšené termogeneze a podařilo se nám ukázat rozdíly v adaptaci na chlad mezi pohlavími.
Trnovská J, Šilhavý J, Zídek V, et al. Gender-related effects on substrate utilization and metabolic adaptation in hairless spontaneously hypertensive rat. Physiol Res. 2015;64(1):51-60.
V rámci kmenů laboratorních potkanů se vyskytují 4 mitochondriální haplotypy – dva z nich jsou SHR a F344. V naší další publikaci porovnáváme kmen SHR s kongenním kmenem SHR-mtF344, který obsahuje mitochondriální DNA z kmene F344, přičemž jaderné geny se neliší.
Houštěk J, Vrbacký M, Hejzlarová K, et al. Effects of mtDNA in SHR-mtF344 versus SHR conplastic strains on reduced OXPHOS enzyme levels, insulin resistance, cardiac hypertrophy, and systolic dysfunction. Physiol Genomics. 2014;46(18):671-678.
MITOCHONDRIÁLNÍ PRODUKCE „VOLNÝCH KYSLÍKOVÝCH RADIKÁLŮ“
Dalším naším tématem je výzkum mitochondriální tvorby reaktivních forem kyslíku (ROS), neodborné veřejnosti známých spíše pod pojmem volné kyslíkové radikály. Nedávno jsme například přispěli k objasnění mechanismu tvorby ROS mitochondriální glycerol-3-fosfátdehydrogenázou (Mráček et al. 2013) v hnědotukových mitochondriích. Stejnou tkáň z hlediska produkce ROS zkoumáme i nadále ve spolupráci se švédskými kolegy a o výsledcích našeho společného výzkumu informujeme zde.
Shabalina IG, Vrbacký M, Pecinová A, et al. ROS production in brown adipose tissue mitochondria: The question of UCP1-dependence. Biochim Biophys Acta – Bioenerg. 2014;1837(12):2017-2030.
Jak zpomalit stárnutí?
Projevy stárnutí jsou částečně přičítány hromadění poškození „volnými kyslíkovými radikály“ v průběhu života. Naše výsledky nyní ukazují, že tvorbu škodlivých „volných kyslíkových radikálů“ nelze zastavit tak, jak jsme dlouho předpokládali.
Jako jediná živočišná skupina disponují savci hnědou tukovou tkání, termogenním orgánem, který zejména u novorozenců brání prochladnutí. K aktivaci této tkáně proto dochází především při adaptaci na chlad. Produkci tepla zde zajišťuje protein označovaný jako UCP1 (z anglického názvu uncoupling protein 1).
Hnědá tuková tkáň je pro své unikátní vlastnosti a přítomnost výlučně u savců v našem ústavu intenzivně studována. Na podzim zde na webu o svých výsledcích informovali naši kolegové z Oddělení biologie tukové tkáně, kteří zkoumali vliv žlučových kyselin v potravě na zvýšení energetického výdeje prostřednictvím hnědého tuku, čímž dochází ke snížení rizika vzniku obezity (článek si můžete přečíst zde).
Stejný mechanismus, kterým dochází k produkci tepla a tím výdeji energie v hnědé tukové tkáni, by však mohl mít ještě další uplatnění – snížení produkce škodlivých „volných kyslíkových radikálů“ (odborně reaktivních forem kyslíku, zkráceně ROS – z anglického reactive oxygen species). ROS poškozují naše buňky a tkáně, a tak se podílejí na jejich přirozeném stárnutí.
My jsme se ve spolupráci s vědci ze Stockholmu (Prof. Cannon) pokusili objasnit úlohu UCP1 při tvorbě ROS v hnědé tukové tkáni, přičemž jsme srovnávali myš bez funkčního proteinu UCP1 s myší zdravou. Výsledky naznačují, že naděje ani peníze vkládané do UCP1 jako ochránce před škodlivými ROS nemusí být namířeny tím správným směrem. Ukázalo se, že aktivita proteinu UCP1 nemá žádný vliv na snížení produkce ROS za fyziologických podmínek, alespoň v hnědé tukové tkáni. Navíc jsme zjistili, že při chladové adaptaci, kdy jsou myši trvale chovány při 4 °C, sice dochází k aktivaci hnědého tuku a nárůstu obsahu a aktivity UCP1, ale zároveň se zvyšuje produkce ROS ve srovnání s myší s nefunkčním UCP1. Přitom očekávání byla přesně opačná. Pokud se tato pozorování potvrdí i v dalších tkáních, bude nutné hypotézu o blahodárném účinku UCP1 na buněčné stárnutí přehodnotit a hledat jiný způsob, jak snížit tvorbu ROS v našem těle.
Spolupořádání respirometrického workshopu
28.–29. 5. 2013 se na Přírodovědecké fakultě UK v Praze konal workshop zaměřený na práci s unikátním respirometrem neboli oxygrafem značky OROBOROS (International O2k-Workshop on High-Resolution Respirometry), který používáme při studiu buněčného dýchání. Více
Kyslíkové radikály a mitochondriální glycerol-3-fosfát dehydrogenáza
Když zapálíte oheň, nehoří nikdy dokonale a důsledkem je stoupající kouř. Podobně ani buněčné dýchání nefunguje na 100 %. Vedlejším produktem jsou zde reaktivní formy kyslíku, zvané také kyslíkové radikály (reactive oxygen species, ROS).
Bývá jim připisována negativní úloha v rozvoji mnoha onemocnění stejně jako v procesu stárnutí. Doposud však u mnoha enzymů, které ROS produkují, vědci neznají přesný mechanizmus, jak k jejich vzniku dochází. Přitom poznání mechanizmu je důležitým předpokladem pro případné hledání látek s terapeutickým účinkem. K porozumění detailů tohoto procesu u jednoho z enzymů – mitochondriální glycerol-3-fosfát dehydrogenázy – jsme nedávno přispěli i my. Celý článek si můžete přečíst v prestižním časopise BBA Bioenergetics.
Tomáš Mráček, Eliška Holzerová, Zdeněk Drahota, Nikola Kovářová, Marek Vrbacký, Pavel Ješina, Josef Houštěk: ROS generation and multiple forms of mammalian mitochondrial glycerol-3-phosphate dehydrogenase
Mitochondriální glycerol-3-fosfát dehydrogenáza
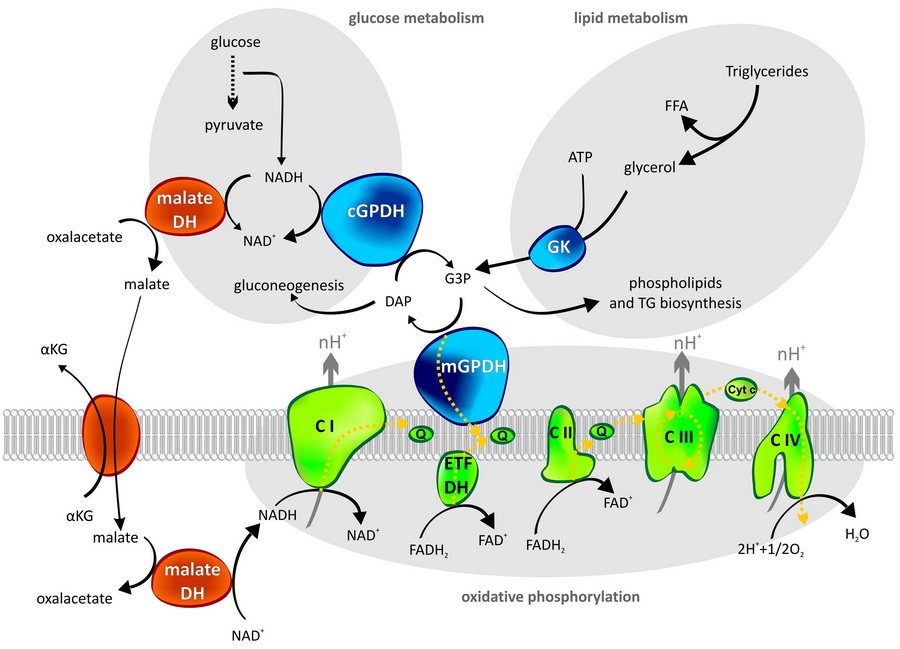
Tento enzym propojuje metabolizmus sacharidů a lipidů s mitochondriálním respiračním řetězcem. Představuje jednu z možných drah, kterou dochází k přenosu redukčních ekvivalentů z cytosolu do mitochondrií. Jedná se o tzv. glycerolfosfátový člunek, který vytvářejí dva enzymy – mitochondriální (mGPDH) a cytosolická (cGPDH) glycerol-3-fosfát dehydrogenáza. Druhou cestu redukčních ekvivalentů do mitochondrií pak představuje rozšířenější člunek malát-aspartátový.
Publikace
Alánová; Petra - Alán; Lukáš - Opletalová; Barbora - Bohuslavová; Romana - Abaffy; Pavel - Matějková; Kateřina - Holzerová; Kristýna - Benák; Daniel - Kaludercic; N. - Menabo; R. - Di Lisa; F. - Ošťádal; Bohuslav - Kolář; František - Pavlínková; Gabriela HIF-1α limits myocardial infarction by promoting mitophagy in mouse hearts adapted to chronic hypoxia. Acta Physiologica. 2024; 240(9); e14202.
IF = 5.6
Čunátová; Kristýna - Vrbacký; Marek - Puertas-Frias; Guillermo - Alán; Lukáš - Vanišová; M. - Saucedo-Rodríguez; María José - Houštěk; Josef - Fernández-Vizarra; E. - Neužil; Jiří - Pecinová; Alena - Pecina; Petr - Mráček; Tomáš Mitochondrial translation is the primary determinant of secondary mitochondrial complex I deficiencies. iScience. 2024; 27(8); 110560.
IF = 4.6
Novotná; Eliška - Miloševič; Mirko - Průková; Dana - Magalhaes-Novais; Silvia - Dvořáková; Šárka - Dmytruk; Kristina - Gemperle; J. - Zudová; Dagmar - Nickl; Tereza - Vrbacký; Marek - Rosel; D. - Filimonenko; Vlada - Procházka; Jan - Brabek; J. - Neužil; Jiří - Rohlenová; Kateřina - Rohlena; Jakub Mitochondrial HER2 stimulates respiration and promotes tumorigenicity. European Journal of Clinical Investigation. 2024; 54(6).
IF = 4.4
Sharma; P. - Maklashina; E. - Voehler; M. - Balintová; Soňa - Dvořáková; Šárka - Kraus; Michal - Váňová Hadrava; Kateřina - Nahácka; Zuzana - Zobalová; Renata - Boukalová; Štěpána - Čunátová; Kristýna - Mráček; Tomáš - Ghayee; H. K. - Pacak; K. - Rohlena; Jakub - Neužil; Jiří - Cecchini; G. - Iverson; T. M. Disordered-to-ordered transitions in assembly factors allow the complex II catalytic subunit to switch binding partners. Nature Communications. 2024; 15(1); 473.
IF = 14.7